В развитие проводимых в Лаборатории каталитического синтеза ИНК РАН (рук. д.х.н., проф. РАН Дьяконов В.А.) исследований в области разработки новых металлоорганических реакций, катализируемых комплексами переходных металлов (реакции Джемилева), а также их применения в полном стереоселективном синтезе природных и практически важных биологически активных органических соединений в 2020 году, совместно с сотрудниками новой Лаборатории молекулярного дизайна и биологического скрининга веществ-кандидатов для фарминдустрии ИНК РАН (рук. д.м.н., проф. Джемилева Л.У.), достигнуты и опубликованы в высокорейтинговых зарубежных журналах Q1 по WoS, следующие наиболее важные результаты:
Природные соединения, содержащие бис-метиленразделенные Z-двойные связи: Природные источники, эффективные стратегии полного синтеза, биологическая активность и перспективы (Приглашенный обзор)
По результатам приглашенного доклада на международной конференции “Natural Products in Drug Discovery and Human Health (NatProdDDH)”, Лиссабон, Португалия (докладчик д.х.н., проф. РАН Дьяконов В.А.), проводимой под эгидой Phytochemical Society of Europe, опубликован обзор, в котором обобщены данные о природных соединениях – высших карбоновых кислотах, ацетогенинах, лембехинах, феромонах насекомых, содержащих в своей структуре бис-метиленразделенные Z-двойные связи, общих подходах к их синтезу и проявляемых биологических активностях. Обзор будет интересен широкому кругу исследователей, работающих в области органической, медицинской и фито- и биохимии, а также фармакологии, и фармакогнозии, так как содержит сведения по основным стратегиям стереоселективного формирования бис-метиленразделенных Z-двойных связей, выявленной биологической активности перечисленных природных соединений, их полном синтезе и содержании в растениях, животных и микроорганизмах.
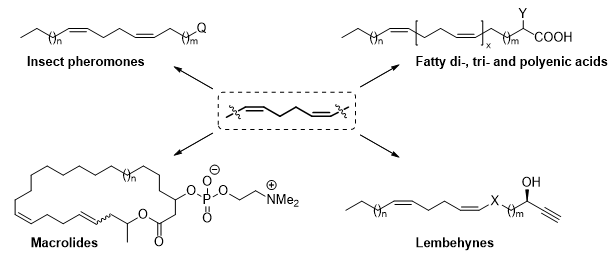
V.A. D’yakonov, L.U. Dzhemileva, U.M. Dzhemilev, Natural Compounds with bis-Methylene-Interrupted Z-Double Bonds: Plant Sources, Strategies of Total Synthesis, Biological Activity, and Perspectives, Phytochemistry Reviews, 2020 (https://doi.org/10.1007/s11101-020-09685-6). (Q1).
Природный алкинол лембехин С: полный синтез и изучение механизмов противоопухолевого действия
С применением на ключевой стадии синтеза новой реакции Ti-катализируемого кросс-сочетания O-содержащих и алифатических 1,2-диенов впервые разработан Z-стереоселективный метод синтеза природного алкинола – лембехина С, содержащего в своей структуре 1Z,5Z,9Z-триеновый фрагмент, с высоким выходом. Впервые показано, что лембехин С проявляет умеренную цитотоксическую активность в отношении опухолевых линий Jurkat, K562, U937, HL60, а также является эффективным индуктором апоптоза в опухолевых клетках линии Jurkat, причем механизм инициации клеточной смерти активируется по митохондриальному пути. Ингибирование клеточного цикла лембехином С происходит по типу митотической катастрофы. При изучении влияния синтезированного природного лембехина С на сигнальные пути в клетке получены данные о том, что наибольшее влияние изучаемое соединение оказывает на Аkt, p38, CREB и p70S6K.
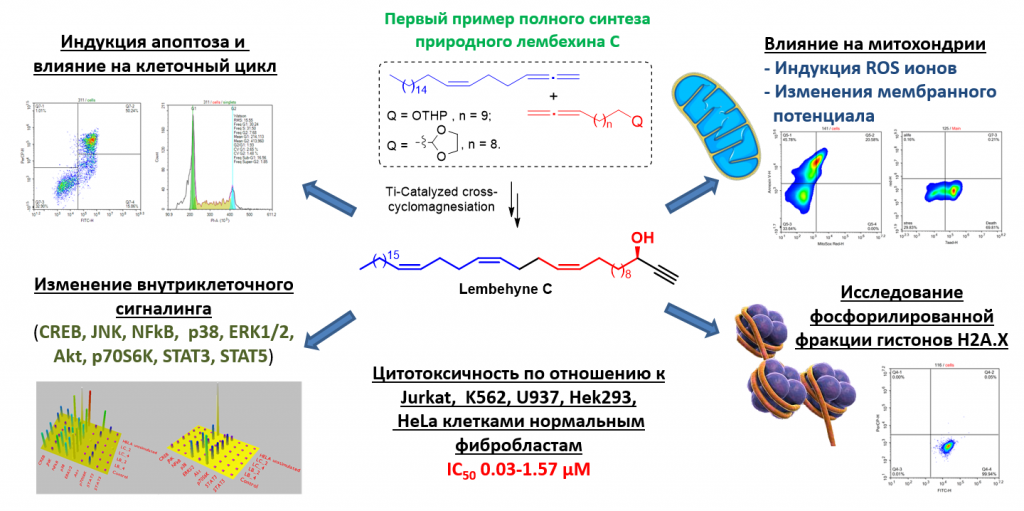
V.A. D’yakonov, A.A. Makarov, L.U. Dzhemileva, E.N. Andreev, E.Kh. Makarova, U.M. Dzhemilev, Total Synthesis of Natural Lembehyne C and Investigation of Its Cytotoxic Properties, J. Nat. Prod. 2020, 83(8), 2399–2409. (https://doi.org/10.1021/acs.jnatprod.0c00261). (Q1).
Стереоселективный синтез ацетиленовых производных природного лембехина В – эффективные индукторы апоптоза в опухолевых клетках
Разработан оригинальный метод синтеза ацетиленовых производных природного лембехина B, основанный на применении на ключевой стадии новой реакции Ti-катализируемого кросс-цикломагнирования О-содержащих и алифатических 1,2-диенов с помощью реактивов Гриньяра, с высокими выходами (50-67%) и селективностью (>98%). С целью изучения влияния структуры полученных ацетиленовых производных лембехина B на проявляемую противоопухолевую и нейритогенную активность, синтезирована линейка аналогов лембехина B с различным удалением терминальной гидрокси-группы от 1,3-диинового фрагмента и изучена их нейритогенная активность на клетках нейробластомы мыши Neuro2A, а также цитотоксичность, индукция апоптоза и влияние на клеточный цикл по отношению к опухолевым линиям Jurkat, U937, K562, HeLa and Hek293.
Установлено, что производные лембехина B имеют дозозависимое влияние на клеточную популяцию и вызывают индукцию раннего и позднего апоптоза, тогда как исходный лембехин B в большей степени является индуктором раннего апоптоза, что подтверждается исследованием влияния на клеточный цикл. Если лембехин B, помимо накопления клеток в гиподиплоидной популяции (G0), в основном, вызывает остановку клеточного цикла в G1 фазе, то его 1,3-дииновые аналоги оказывают прямое влияние на S-фазу, вызывая ее остановку и снижая популяцию клеток в G2 фазе, что также, в конечном итоге, обогащает гиподиплоидную популяцию клеток. Исследования биологической активности in vitro выявили высокий потенциал синтезированных соединений для их применения в качестве основы при разработке современных противоопухолевых или нейритогенных препаратов для лечения социально значимых заболеваний человека. В настоящее время в данной области нами проводятся интенсивные исследования по изучению молекулярных механизмов лембехин-индуцированного нейритогенеза и противоопухолевой активности природных и синтетических лембехинов с привлечением современных молекулярно-биологических подходов в проточной цитометрии, многопараметрического анализа сигнальных путей, иммуногистохимических исследований и вестерн-блоттинга, а также флуоресцентной спектроскопии.
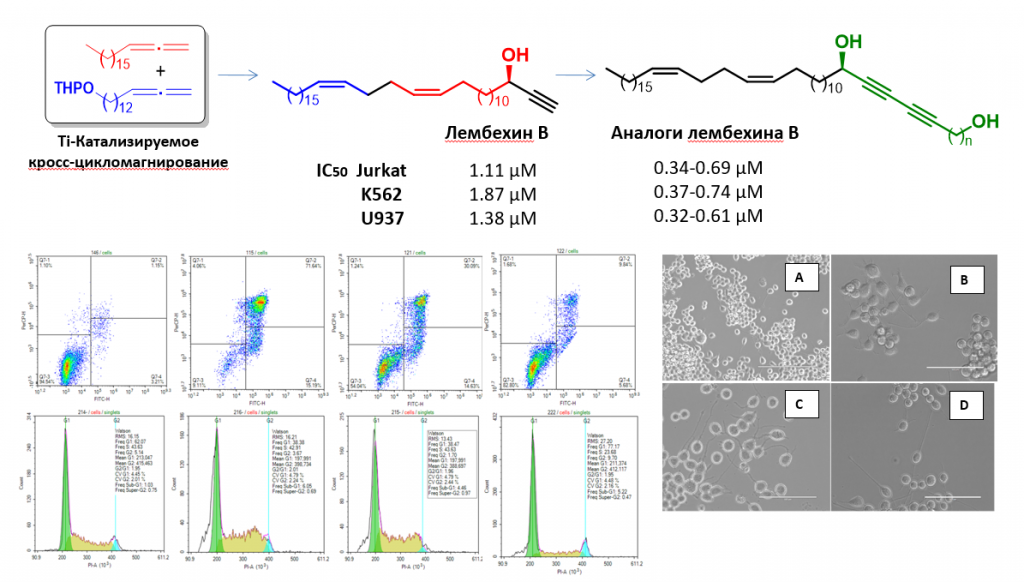
L.U. Dzhemileva, A.A. Makarov, E.N. Andreev, M.M. Yunusbaeva, E.Kh. Makarova, V.A. D’yakonov, U.M. Dzhemilev, New 1,3-Diynoic Derivatives of Natural Lembehyne B: Stereoselective Synthesis, Anticancer and Neuritogenic Activity, ACS Omega, 2020, 5(4), 1974-1981 (https://doi.org/10.1021/acsomega.9b03826). (Q2).
Новые синтетические производные 5Z,9Z-диеновых кислот: стереоселективный синтез и изучение их противоопухолевой активности
В развитие исследований по синтезу эффективных ингибиторов человеческих топоизомераз, разработан стереоселективный метод получения синтетических аналогов природных 5Z,9Z-диеновых кислот реакциями этерификации алифатических и ароматических спиртов и карбоновых кислот с (5Z,9Z)-1,14-ундека-5,9-диендикарбоной кислотой и (5Z,9Z)-1,14-ундека-5,9-диендиолом. Установлено, что синтезированные кислоты проявляют высокий цитотоксический эффект в отношении ряда опухолевых и нормальных клеточных линий (Jurkat, HL-60, K562, U937, Fibroblasts), приводя к гибели клеток через апоптоз, вызывая арест клеточного цикла в фазе G1/S. При этом наблюдается заметное снижение активности непредельных кислот при замене ароматических радикалов на алифатические, а также с увеличением длинны алифатического радикала. Синтезированные кислоты оказывают ингибирующее действие на топоизомеразу I. Кроме того, с применением многопараметрического анализа MAGPIX в результате попарного сравнения фосфорилированной и нефосфорилированной фракции киназ опухолевых клеток Jurkat, обработанных кислотами, установлено, что основные изменения соотношения этих двух фракций выражены для сигнальных путей Аkt, p70S6K, ERK1\2, NfkB и CREB.
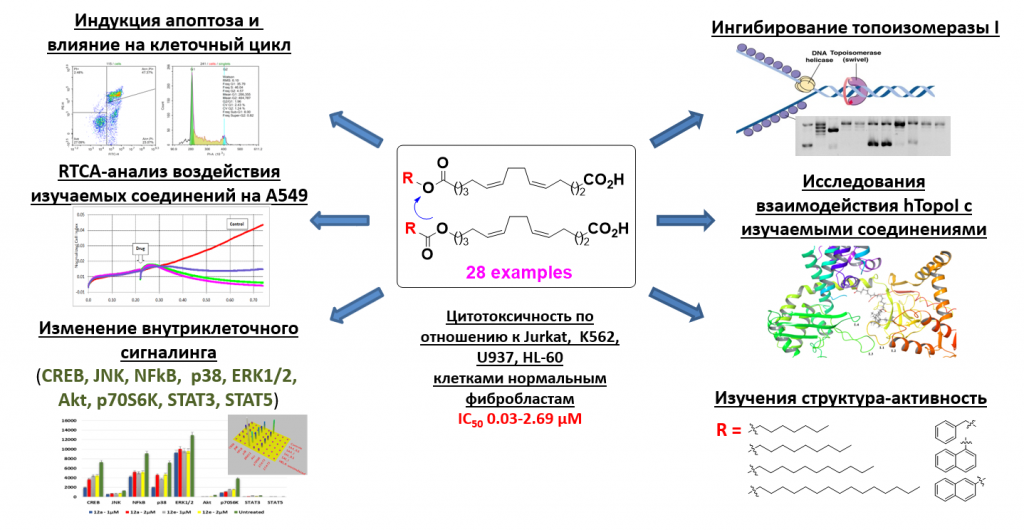
A.A. Makarov, L.U. Dzhemileva, A.R. Salimova, E.Kh. Makarova, I.R. Ramazanov, V.A. D’yakonov, U.M. Dzhemilev, New Synthetic Derivatives of Natural 5Z,9Z-Dienoic Acids: Stereoselective Synthesis and Study of the Antitumor Activity, Bioorg. Chem., 2020, 104, 104303 (https://doi.org/10.1016/j.bioorg.2020.104303). (Q1).
Новые 1Z,5Z-диеновые макродиолиды: каталитический синтез и изучение противоопухолевой активности, индукции апоптоза и влияния на клеточный цикл
Разработана оригинальная стратегия синтеза ранее неописанных непредельных макродиолидов, содержащих 1Z,5Z-диеновый фрагмент с выходами 44-80% и стереоселективностью (>98%) межмолекулярной этерификацией α,ω-диолов с α,ω-алка-nZ,(n+4)Z-диендикарбоновыми кислотами (1,12-додека-4Z,8Z-диендикарбоновая кислота, 1,14-тетрадека-5Z,9Z-диендикарбоновая кислота, 1,18-октадека-7Z,11Z-диендикарбоновая кислота), катализируемой трифлатом гафния Hf(OTf)4. Непредельные Z,Z-дикарбоновые кислоты получены последовательными реакциями гомо-цикломагнирования тетрагидропирановых эфиров O-содержащих 1,2-диенов с помощью EtMgBr в присутствии металлического Mg и катализатора Cp2TiCl2 (10 мол %) и окисления образующихся после кислотного гидролиза соответствующих магнезациклопентанов с помощью реактива Джонса. Синтезированные макродиолиды проявляют высокую цитотоксическую активность in vitro в отношении опухолевых клеточных линий Jurkat, K562, U937, Hek293 и HeLa. Показано, что как индукторы программируемой клеточной смерти, макродиолиды инициируют апоптоз в клетках линии Jurkat по митохондриальному пути. Также было показано, что синтезированные макродиолиды эффективно подавляют процессы фосфорилирования Аkt, p38 киназ и транскрипционного фактора CREB в опухолевых клетках.
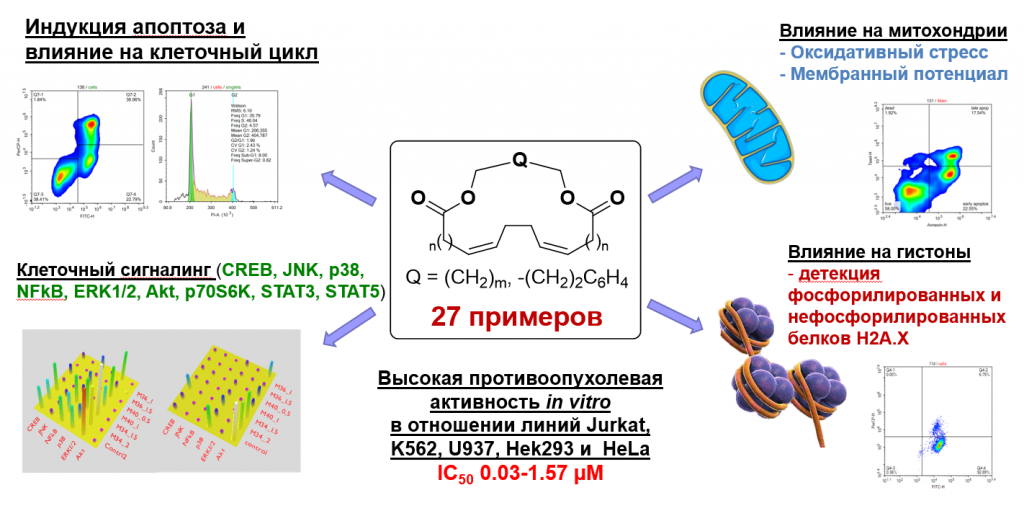
L.U. Dzhemileva, V.A. D’yakonov, I.I. Islamov, M.M. Yunusbaeva, U.M. Dzhemilev, New 1Z,5Z-Diene Macrodiolides: Catalytic Synthesis, Anticancer Activity, Induction of Mitochondrial Apoptosis, and Effect on the Cell Cycle, Bioorg. Chem., 2020, 99, 103832 (https://doi.org/10.1016/j.bioorg.2020.103832). (Q1).
Таким образом, в рамках обзора нами обобщены наиболее эффективные подходы к формированию бис-метиленразделенных 1Z,5Z-ди-, 1Z,5Z,9Z-три- и 1Z,5Z,9Z,nZ-полиеновых соединений, а также эффективных стратегий полного синтеза природных фероменов насекомых, кислот, ацетогенинов и алкинолов, содержащих в своей структуре указанные фрагменты. Кроме того, показано, что разработанные в Лаборатории каталитического синтеза новые металлоорганические реакции Ti-каталитизируемого межмолекулярного цикломагнирования 1,2-диенов являются эффективным инструментом для построения бис-метиленразделенных Z-ди-, три- и полиенов заданной структуры. Совместно с сотрудниками Лаборатории молекулярного дизайна и биологического скрининга веществ-кандидатов для фарминдустрии ИНК РАН установлено, что перечисленные соединения обладают высоким биомедицинским потенциалом для разработки на их основе современных противоопухолевых, антибактериальных, противомикробных и нейропротективных препаратов для лечения социально значимых заболеваний человека.
Институт нефтехимии и катализа УФИЦ РАН (ИНК РАН), г. Уфа


